
L’objectif de l’équipe GlioME est d’identifier des cibles pertinentes, de caractériser leur rôle fonctionnel dans la croissance et la progression des tumeurs afin de développer des stratégies thérapeutiques innovantes pour traiter le glioblastome (GBM).
Le GBM est la tumeur cérébrale primitive la plus fréquente et la plus agressive, avec une survie médiane de 15 mois après le diagnostic (PMID: 34185076). Le traitement standard du GBM consiste en une chirurgie suivie d’une radiothérapie et d’une chimiothérapie (PMID: 15758009). Ce protocole a été établi en 2005 et n’a pas été modifié depuis; il y a donc un besoin urgent de développer de nouvelles stratégies thérapeutiques.
La résistance du GBM au traitement est principalement due à:
- l’hétérogénéité moléculaire et cellulaire du GBM , y compris la présence de cellules souches cancéreuses (CSC)
- la spécificité du microenvironnement tumoral GBM entouré d’une barrière hémato-encéphalique qui empêche la pénétration des médicaments.
Au sein de notre équipe GlioME nous développons plusieurs expertises pour faire face à ces défis : modélisation de modèles précliniques, développement de systèmes d’administration de médicaments sur mesure, techniques d’imagerie et immunophénotypage, recherche translationnelle.
Nous adoptons une double approche « du lit du patient à la paillasse » et inversement pour favoriser et accélérer le transfert de nos recherches à la clinique :
- du lit du patient à la paillasse: nous identifions les cibles cliniques pertinentes à partir d’échantillons humains (centre de ressources biologiques, biobanque), nous étudions leur rôle dans la croissance et la progression tumorale, et nous étudions comment elles modulent le microenvironnement du GBM en développant des modèles précliniques pertinents dérivés de l’homme et chez la souris.
- de la paillasse au lit du patient : nous développons des stratégies thérapeutiques innovantes allant de nos modèles précliniques dérivés de l’homme et de souris à l’essai clinique de phase précoce.
Ces approches sont réalisables grâce à :
- un duo de responsables d’équipe fondamental/clinique: le Dr Aurélie Tchoghandjian, CRCN CNRS, experte dans l’étude des gliomes, en particulier le GBM, spécialisée dans le développement de techniques pour étudier le microenvironnement tumoral (clarification et imagerie à feuilles de lumière, cytométrie en flux multiparamétrique, imagerie à deux photons, protéomique spatiale multiplexée) et avec une grande expérience dans le développement de modèles précliniques du gliome, modèles murins et cultures 3D dérivées d’échantillons humains de GBM (PDX et tumoroïdes). Le Pr Emeline Tabouret, MD, PhD, professeure à l’Université d’Aix-Marseille, oncologue médicale spécialisée en neuro-oncologie à l’APHM, exerçant dans le service de neuro-oncologie et dans l’unité de phase I CLIP2 (Centre Labelisé INCa d’essais Phases Précoces), avec une grande expérience dans la mise en place et la coordination de projets précliniques et translationnels (HITCH NCT06045065, Gliomanoid NCT03971812, MMPredict NCT03526822, CIRANO) et d’essais cliniques académiques de phase I pour les patients atteints de GBM (Proglio, PHRC-K 2019).

- la pluridisciplinacité de notre équipe: l’équipe GlioME rassemble des médecins/maîtres de conférence experts en neuro-oncologie (deux neuro-oncologues, trois pathologistes et une radiothérapeute), trois chercheurs fondamentaux (deux CRCN CNRS et une MCU) et un personnel technique important avec deux IR, cinq IE, un technicien et un agent administratif. De plus, l’équipe accueille actuellement trois doctorants et un ATER.


Notre équipe GlioME « Gliomagenèse et MicroEnvironnement » mène une recherche préclinique à visée translationnelle vers le patient. Le but de nos recherches est de mieux comprendre la biologie des glioblastomes (GBM) pour élaborer des approches thérapeutiques innovantes. Nous cherchons à comprendre comment ces tumeurs se développent, pourquoi elles sont résistantes aux thérapies existantes et comment les cellules autres que les cellules tumorales favorisent le développement tumoral et la résistance aux traitements. L’objectif final de notre équipe est de développer de nouvelles stratégies thérapeutiques afin de mettre en place des essais cliniques de phase précoce pour les traitements les plus prometteurs.
Contexte scientifique de l’équipe
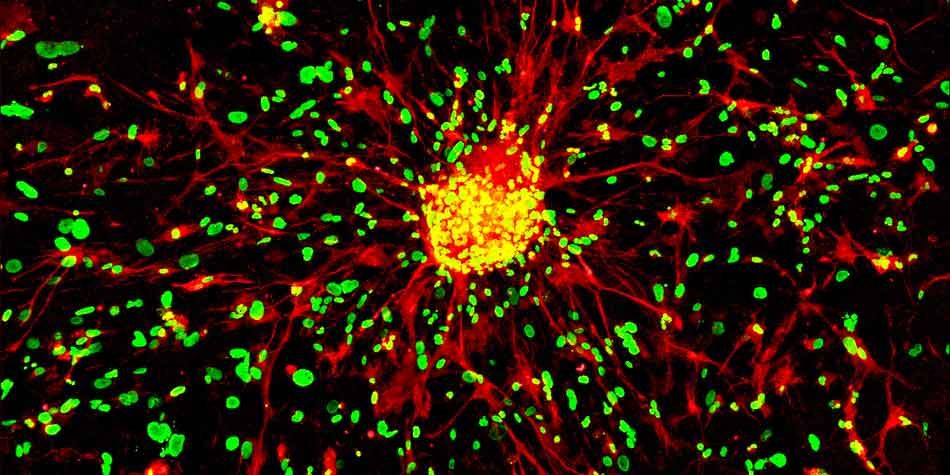
Notre équipe a précédemment montré que les cellules ayant des propriétés de cellules souches cancéreuses (CSC) étaient identifiables dans les échantillons de glioblastome humain (GBM) en utilisant les biomarqueurs A2B5 et GD3 (PMID: 19243384; 31466399; 35563061). Par ailleurs, les GBM expriment aussi fortement ML-IAP, une protéine inhibitrice de l’apoptose, dont l’inhibition par des mimétiques SMAC, est associée à une diminution du caractère souche des cellules cancéreuses et à une survie prolongée des modèles murins de GBM (PMID: 30920104; 27490930). De plus, nous avons montré que ML-IAP était exprimé par les macrophages associés à la tumeur (TAMs), les cellules de la microglie et les macrophages anti-inflammatoires (Preprint Snacel-Fazy et al.) qui augmentent après l’exérèse chirurgicale. Enfin, notre équipe a montré récemment que la survie globale des modèles souris de GBM pouvait être significativement augmentée en ciblant ces macrophages après l’intervention chirurgicale en utilisant une combinaison de mimétiques SMAC et de traitement local directement appliqué dans la cavité post-opératoire (Preprint Bastiancich et al.).
Principaux objectifs de l’équipe
Les principaux objectifs de l’équipe sont maintenant d’identifier l’implication de ML-IAP et de GD3 dans les FACTEURS DE PROGRESSION du GBM et dans les interactions de la tumeur avec son MICROENVIRONNEMENT afin de concevoir des inhibiteurs spécifiques pour un futur DÉVELOPPEMENT THÉRAPEUTIQUE.
1. FACTEURS DE PROGRESSION: étudier le rôle fonctionnel des acteurs clés de la croissance et de la progression tumorale du GBM.
2. MICROENVIRONNEMENT: déterminer les relations entre la tumeur et son microenvironnement pendant la croissance tumorale et sous traitement.
3. DÉVELOPPEMENT THÉRAPEUTIQUE: développer des thérapies innovantes transférables de la paillasse au lit du patient.
Pour étudier le rôle de nos cibles, nous altérons l’expression de ML-IAP et de GD3 en utilisant des approches chimiques (mimétiques de SMAC [GDC-0152] pour l’inhibition de ML-IAP) et génétiques (ARNsh/ARNsi).
OBJECTIF 1 : FACTEURS DE PROGRESSION
Étudier le rôle fonctionnel de GD3 et de ML-IAP dans le caractère souche des CSC
Nous effectuons des essais clonogéniques pour déterminer le potentiel d’auto-renouvellement et la capacité de prolifération des CSC de GBM en sous-exprimant ML-IAP ou GD3. Nous analysons également l’impact de la modulation de l’expression des marqueurs ciblés sur les capacités de différenciation et de plasticité cellulaire (différenciation divergente, caractère souche, plasticité et marqueurs de différenciation, analyses en RNAseq) des CSC. Enfin, nous étudions l’impact de l’hypoxie sur les caractéristiques des CSC. Les xénogreffes chez la souris nude sont très utiles pour valider le rôle de nos cibles dans le caractère souche des CSC de GBM.
OBJECTIF 2 : MICROENVIRONNEMENT
Déterminer les relations entre la tumeur et son microenvironnement en utilisant des modèles 3D in vitro/ex vivo
En utilisant la vidéomicroscopie, nous analysons les interactions entre les cellules tumorales du GBM et les cellules du microenvironnement, la prolifération des cellules tumorales, la migration des cellules tumorales pendant 1) la croissance du GBM, 2) la résection tumorale et 3) en réponse au traitement (radiothérapie, chimiothérapie, mimétiques SMAC, associations médicamenteuses...). Nous utilisons des modèles 3D que nous avons développés (modèles de co-cultures d’astrocytes/de microglie/de cellules tumorales ; explants de GBM ; tumoroïdes) et des modèles de coupes organotypiques. En utilisant des marquages en immunohistochimie et de la cytométrie en flux, nous déterminons le phénotype et la nature des cellules impliquées dans les processus biologiques identifiés.
Déterminer les relations entre la tumeur et son microenvironnement dans des modèles de souris syngéniques in vivo
Nous combinons imagerie et approches phénotypiques pour déterminer comment nos cibles modulent le microenvironnement du GBM. Nous effectuons de l’imagerie 3D à feuilles de lumière après colorations spécifiques sur organe entier et de la protéomique spatiale pour déterminer les densités, la distribution spatiale et les interactions des cellules du microenvironnement. Pour définir la composition cellulaire précise de nos échantillons, nous utilisons les techniques de cytométrie en flux et de cytométrie de masse. Toutes ces techniques complémentaires permettent de caractériser les différentes sous-populations de cellules immunitaires impliqués dans 1) la croissance du GBM, 2) la récidive du GBM et 3) en réponse au traitement.
Déterminer l’impact de la chirurgie du protocole standard sur le microenvironnement du GBM lors des récidives
Nous combinons imagerie et approches phénotypiques pour déterminer comment la chirurgie peut avoir un impact sur l’apparition et le développement des récidives tumorales. Nous réalisons une chirurgie sur des souris porteuses de tumeurs et évaluons chronologiquement et spatialement les modifications physiologiques qui pourraient stimuler la prolifération des cellules tumorales résiduelles. En caractérisant le microenvironnement post-chirurgical, nous identifions les fenêtres thérapeutiques et les cibles cellulaires qui pourraient être utilisées pour développer des traitements visant à inhiber les récidives.
OBJECTIF 3 : DEVELOPEMENT THERAPEUTIQUE (thérapies ciblées)
Concevoir et tester des siRNA dirigés contre les facteurs de progression que nous avons identifiés
L’objectif final de notre recherche est de concevoir une approche thérapeutique innovante pour cibler la voie ML-IAP et la voie GD3. Nous nous concentrons sur l’approche par siRNA et testons leur efficacité dans la diminution de la prolifération, de l’invasion et du caractère souche des cellules tumorales dans des modèles précliniques in vitro, ex vivo et in vivo.
Développer et évaluer des inhibiteurs optimisés de notre cible d’intérêt
Nous utilisons des techniques de pointe pour développer des inhibiteurs optimisés, efficaces et spécifiques pour antagoniser ML-IAP. Nous testons nos médicaments candidats sur les modèles que nous maîtrisons, 2D, 3D, ex vivo et in vivo.
Développer et évaluer des systèmes d’administration de médicaments pour le traitement du GBM
Nous développons des systèmes d’administration de médicaments personnalisés en systémique ou en local. Après l’identification de médicaments prometteurs, des systèmes d’administration de médicaments adaptés sont conçus en fonction de la voie d’administration et de la nature chimique des molécules. Les formulations sont ensuite développées, caractérisées physico-chimiquement et biologiquement, puis testées à l’aide de modèles précliniques cellulaires et animaux appropriés.
Essais cliniques de phases précoces
Nous transférerons la thérapie la plus prometteuse en phases cliniques précoces grâce à notre implication dans le service d’Assistance-Publique des Hôpitaux de Marseille CLIP2 (Centre Labelisé INCa d’essais Phases Précoces).
















