Notre équipe a été créée en 2012 par la réorganisation de deux équipes de l’UMR_U911 (CRO2), associant ainsi nos expertises moléculaires et cellulaires pour l’étude du cytosquelette et sa régulation par la signalisation redox dans la progression tumorale. Le cytosquelette contrôle de nombreux processus comme l’intégrité mécanique, la cicatrisation de l’épiderme, la polarité cellulaire, la contraction des cellules musculaires, l’ouïe et l’équilibre dans l’oreille interne, le transport axonal dans les neurones et la formation des jonctions neuromusculaires entre les neurones moteur et les cellules musculaires. Par conséquent, des défauts dans les structures cytosquelettiques conduisent à de diverses pathologies comme les cancers et les désordres neurologiques. Le principal objectif de notre équipe est donc d’explorer les bases moléculaires de la régulation du cytosquelette et de la plasticité cellulaire dans le cancer du cerveau (glioblastomes) et dans les processus neurodégénératifs.
Au cours des 5 dernières années, en plus des 52 publications internationales en science fondamentale et appliquée, nous avons identifié de nouveaux agents anti-microtubules (analogue de la combretastatine, brevet PCT/FR2012/000139, Peyrot et al. 2012), un nouveau composé pour la diminution de la pigmentation cutanée isolé à partir d’un venin d’araignée (EP2705830 A1 et WO 2014037111 A2, Luis et al. 2014) et un nouvel inhibiteur peptidique de Nox1, actuellement à l’étude pour traiter les patients atteints de xeroderma pigmentosum (Kovacic et al. 2015).
Les membres de notre équipe sont fortement impliqués dans de nombreux programmes d’apprentissage de la recherche (facultés de pharmacie et de sciences) et dans des programmes internationaux de formation des étudiants doctorants : Maghreb (Arcus, H. Curien, Averroes J. Luis et H. Kovacic), Russie (programme Metchnikov, bourses Marie Curie, V. Peyrot et F. Devred), Brésil (FAPESP, Arcus EsPACA, H. Kovacic).
Des membres de notre équipe sont aussi impliqués dans la plateforme interactome PINT, intégrées dans la plateforme Neuro-Timone (PFNT AMU, 2018-2020).
Notre but est de comprendre les mécanismes de régulation du cytosquelette liés aux pathologies et d’identifier des biomarqueurs et de nouveaux composés pharmacologiques actifs pour le traitement du cancer et des maladies neurodégénératives en nous focalisant particulièrement sur le cytosquelette de tubuline et ses protéines associées, les Rho-GTPases, les intégrines et la signalisation redox.
Sujet 1 : les modifications post-traductionnelles de Tau (PTM) en neuro-oncologie : de la paillasse au chevet du patient
(P. Barbier, G. Breuzard, F. Devred, A. Pagano)
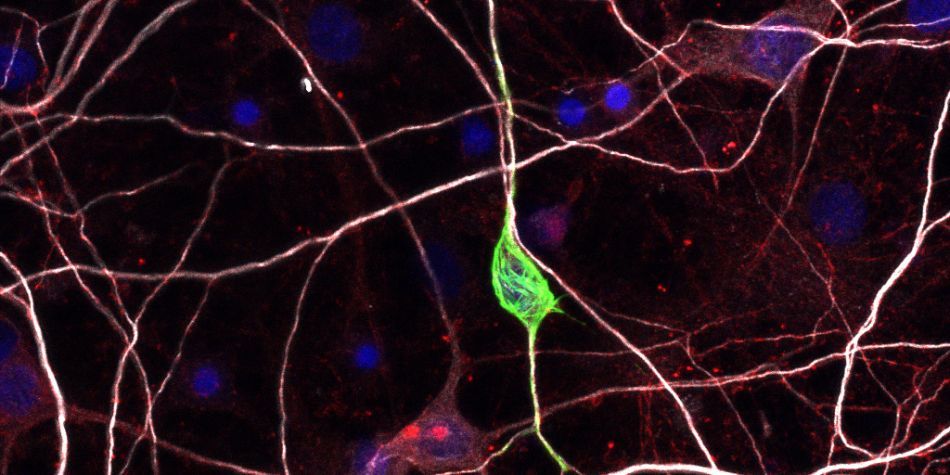
Tau est une protéine associée aux microtubules (MT) qui stimulent leur formation. Dans la maladie d’Alzheimer, il y a une perte de liaison Tau/MT et une augmentation des modifications post-traductionnelles de la protéine Tau (phosphorylations, acétylations et oxydation). De manière intéressante, nous avons récemment montré en collaboration avec l’équipe GLIOME (équipe 8 de l’INP) que certaines phosphorylations spécifiques de Tau représentaient un marqueur de mauvais pronostic dans le glioblastome. La dérégulation de l’interaction Tau/MT liée à la phosphorylation de Tau semble être un lien commun entre certains cancers et la maladie d’Alzheimer. Nous étudions donc l’impact de la phosphorylation de Tau et des autres modifications post-traductionnelles de cette protéine du niveau moléculaire jusqu’au patient pour identifier de nouveaux marqueurs pronostics permettant une meilleure prise en charge thérapeutique de ces patients.
La protéine Tau ayant environ 80 sites différents de phosphorylation (40 d’entre eux ayant été rapportés comme phosphorylés dans la maladie d’Alzheimer), nous avons initié une approche compréhensive par protéomique sur des modèles cellulaires et des explants tumoraux. Les kinases situées en amont de Tau représentent également des cibles de choix pour améliorer le pronostic des patients atteints d’un glioblastome présentant une protéine Tau phosphorylée. Pour identifier la ou les kinases impliquées nous avons commencé une étude kinomique basée sur la technologie Pamgene (https://www.pamgene.com). Notre équipe est d’ailleurs un centre test de cette technologie pour la région de Marseille.
Nous cherchons à déchiffrer au niveau moléculaire à la fois l’architecture du complexe Tau/MT et sa régulation par les modifications post-traductionnelles en collaboration avec les équipes de V. Belle (UMR7281) et d’I. Landrieu (UMR8576). Au travers d’approches interdisciplinaires originales (Spin Site Directed Labeling combinée à de la spectroscopie EPR ; RMN) nous caractérisons l’assemblage du complexe, les propriétés dynamiques et les transitions structurelles possibles de la protéine Tau en solution ou associée aux MT, en relation avec les modifications post-traductionnelles. La validation dans des modèles cellulaires sera réalisée par des méthodes d’imagerie cellulaire basée sur la fluorescence, comme le FRET ou le FRAP, et permettra d’étudier ces interactions in situ. En effet, notre expertise dans le domaine de la biophysique cellulaire nous a déjà permis de montrer dans des cellules vivantes que le Taxol et le taux d’acétylation de l’alpha-tubuline affecte la distribution de la protéine Tau le long des MT (Breuzard et al. J. Cell Sci., 2013) et que la stathmine se lie directement le long du MT et pourrait participer à la dissociation des protofilaments quand l’extrémité plus du MT atteint les protéines de stathmine (Nouar et al. FASEB Journal, 2016).
Sujet 2 : Combattre la résistance et améliorer les thérapies disponibles
(F. Garrouste, L. Leloup)
Notre équipe a révélé l’importance de l’activité des NADPH Oxydases (en particulier de Nox1) dans l’efficacité des thérapies anti-cancéreuses basées sur les sels de platine. Nos récents travaux montrent que l’oxaliplatine exacerbe l’activité de Nox1 et des calpaïnes, responsable de l’activation de voies de signalisation permettant aux cellules tumorales de résister aux traitements. Nous étudions actuellement l’importance de cette voie Nox1/calpaïnes dans la réponse des glioblastomes au cisplatine en fonction du statut mutationnel du récepteur EGFR (mutation EGFRvIII).
Sujet 3 : identification de biomarqueurs avec un potentiel thérapeutique
(F. Devred)
L’étude des protéines impliquées dans le développement des protéinopathies est une étape nécessaire à la compréhension des mécanismes moléculaires de ces pathologies, ce qui pourrait ouvrir la voie à de nouvelles stratégies thérapeutiques. Dans le cadre de cette étude, nous étudions l’impact de différents facteurs endogènes et exogènes (comme les mutations, les modifications post-traductionnelles et les ions métalliques) sur les fonctions physiologiques et l’agrégation pathologique de protéines comme Tau, TDP-43, le peptide β-amyloïde, les synucléines, etc…
L’utilisation de méthodes biophysiques complémentaires, incluant la microcalorimétrie, les méthodes spectrales, la dispersion dynamique de la lumière, la microscopie électronique, etc… (voir PINT), ne nous permet uniquement de caractériser les interactions de ces protéines avec différentes cibles et drogues potentielles mais aussi de révéler les mécanismes de leur oligomérisation et/ou agrégation. Enfin, nous étudions actuellement l’activité de deux nouvelles molécules anti-Alzheimer dont l’efficacité a été prouvée dans des modèles murins (Tsvetkov et al. JAD 2015).
Sujet 4 : identification de nouveaux composés actifs
(J. Luis)
Forts de notre expertise dans l’étude des agents impactant la polymérisation des MT, les intégrines et la signalisation oxydative, nous cherchons à identifier de nouveaux composés pharmacologiques actifs en collaboration avec des partenaires externes (académiques ou industriels). Nous avons récemment sélectionné la base de données des molécules bioactives Biotoxan® de notre partenaire Latoxan pour la recherche de nouveaux agents ciblant les MT (en collaboration avec l’UMR7273). Nous avons ainsi identifié un nouveau peptide actif et développons actuellement des analogues peptidomimétiques.
Notre équipe est ouverte à la communauté scientifique pour les analyses moléculaires et cellulaires de nouveaux composés ciblant la tubuline, les intégrines, les NADPH oxydases et les calpaïnes.
Collaborateurs
- François Guerlesquin – IMM, Marseille
- Santiago Rivera – INP, Marseille
- Cyrille Garnier – Montpellier,
- Natalya Ninkina – IPAC, RAS, Moscou
- Vladimir Buchman – Cardiff
- Andrei Golovin, MSU, Moscou
- Eugene Zernii, MSU, Moscou
Soutien financier
- Marie Curie
- Région PACA
- ARTC Sud
- Fondation ARC
- Cancéropôle PACA
- Gefluc

